BS. Hoàng Văn Trung
1. Tóm tắt
Còn ống động mạch (Patent ductus arteriosus – PDA) là một phần tình trạng bệnh điển hình của trẻ non tháng, với tỷ lệ mắc bệnh cao 80-90% ở trẻ nhẹ cân khi sinh trước 26 tuần tuổi thai. Trong khi ống động mạch có khả năng tự đóng ở trẻ đủ tháng, thì ít gặp hơn ở những trẻ sinh non. PDA có liên quan đến tăng tỷ lệ tử vong và các bệnh đi kèm khác nhau bao gồm suy tim, cần hỗ trợ hô hấp, loạn sản phế quản phổi, xuất huyết phổi hoặc nội sọ, và viêm ruột hoại tử. Tuy nhiên, không có mối quan hệ nhân quả đã được chứng minh giữa các bệnh này và sự hiện diện của ống động mạch. Do đó, chỉ định đóng PDA vẫn còn gây tranh cãi. Bài viết này tập trung vào đánh giá siêu âm tim về PDA ở trẻ non tháng và đặc biệt là các dấu hiệu siêu âm tim có ý nghĩa huyết động.
2. Giới thiệu
Trẻ sinh non chiếm 6-12% trẻ được sinh và đại diện cho nhóm chính trẻ sơ sinh được điều trị tại các đơn vị chăm sóc đặc biệt cho trẻ sơ sinh. Trong số các biến chứng điển hình quan sát thấy ở trẻ non tháng, còn ống động mạch gặp khá thường xuyên. Tỷ lệ mắc của nó tỷ lệ nghịch với tuổi thai non tháng, với tỷ lệ khoảng 20% ở trẻ sinh non ở tuần 32 tuổi thai so với ước tính 80-90% ở trẻ cực kỳ nhẹ cân với tuổi thai dưới 26 tuần [1, 2]. Khả năng tự đóng của ống động mạch ở trẻ đủ tháng không mắc bệnh tim bẩm sinh là rất cao, ở trẻ non tháng tỷ lệ đóng kém hơn [1-3]. Tuy nhiên, các nghiên cứu gần đây đã chỉ ra rằng PDA sẽ tự đóng vào cuối tuần đầu tiên sau sinh ở khoảng 73% trẻ sinh non với tuổi thai là 28 tuần [3].
Theo các tài liệu quốc tế, PDA không chỉ liên quan đến tỷ lệ tử vong gia tăng mà còn có nhiều bệnh đi kèm khác nhau [1, 2, 4, 5]. Chúng bao gồm suy tim, cần hỗ trợ hô hấp, cần oxy bổ sung, loạn sản phế quản phổi, xuất huyết phổi, xuất huyết não thất, tưới máu não bất thường và viêm ruột hoại tử. Trong bối cảnh đó, chiến lược đóng ống động mạch bằng thuốc hoặc phẫu thuật ở trẻ sơ sinh non tháng đã trở thành thông lệ vào những năm 1990. Ngày nay, chúng ta biết rằng không có mối quan hệ nhân quả thực sự nào được chứng minh giữa tỷ lệ tử vong, bệnh lý sơ sinh và PDA [2, 5]. Do đó, các chỉ dẫn đóng PDA đã giảm đáng kể và quy trình này vẫn còn gây tranh cãi. Cách tiếp cận hiện nay là hạn chế điều trị can thiệp cho trẻ sơ sinh, tức là trẻ sơ sinh cực kỳ nhẹ cân, đặc biệt là những trẻ được hỗ trợ hô hấp và có nguy cơ tiến triển PDA có ý nghĩa huyết động [5].
Vì các dấu hiệu lâm sàng của PDA không nhạy hoặc đủ độ đặc hiệu, tất cả trẻ sơ sinh cực kỳ non tháng có nguy cơ tiến triển PDA nên được siêu âm tim. Mục tiêu chính của bài tổng quan là xác định và phát triển các bước khác nhau trong đánh giá siêu âm tim của trẻ sơ sinh non tháng.
3. Đánh giá siêu âm tim của PDA
3.1. Tổng quan
Điều quan trọng là phải xem xét một vài hướng dẫn chung khi đánh giá PDA. Mặc dù DA là trọng tâm của siêu âm tim, tuy nhiên trẻ luôn phải được siêu âm tim một cách hoàn chỉnh trước tiên. Siêu âm tim ban đầu cho phép loại trừ (i) bệnh tim bẩm sinh về cấu trúc, (ii) đo lường chức năng hai thất và (iii) các phần khác nhau của tuần hoàn, ví dụ như áp lực phổi.
Khi thực hiện siêu âm tim chức năng, điều quan trọng là phải ghi nhớ những khó khăn và thách thức liên quan đến việc siêu âm trẻ sơ sinh non tháng. Một số em bé rất nhỏ, chúng có thể bị kích động hoặc không ổn định, nhịp tim cao và đôi khi cửa sổ âm kém, đặc biệt nếu chúng được thở máy và bị bệnh phổi nghiêm trọng. Một số thủ thuật đơn giản bao gồm: đặt em bé ở vị trí tốt nhất (hơi xoay sang trái với cổ hơi ngửa rộng), siêu âm khi trẻ ở trạng thái yên tĩnh và ổn định bất cứ khi nào có thể, và cho phép có nhiều thời gian.
3.2. Đánh giá cụ thể của PDA
Đánh giá siêu âm tim PDA ở trẻ non tháng sẽ giúp các bác sĩ trả lời các câu hỏi sau: Còn PDA hay không? Kích thước của nó bao nhiêu? Hướng của dòng chảy ở đâu? PDA có ý nghĩa huyết động hay không?
Ống động mạch
Có thể nhìn thấy ống động mạch chưa đóng trên mỗi mặt cắt siêu âm cổ điển, nhưng các mặt cắt được ưa thích hơn là mặt cắt cạnh ức trục ngắn và mặt cắt trên ức. Với mặt cắt cạnh ức trục ngắn, DA được nhìn thất ở đáy tim bằng cách di chuyển đầu dò hơi hướng về phía động mạch phổi. Một DA nhỏ có thể dễ dàng thể bỏ sót trên hình ảnh 2D, do đó Doppler xung và Doppler màu là hữu ích (Hình 1). Doppler xung trong thân động mạch phổi hiển thị một dòng chảy tĩnh khi DA đã đóng và dòng chảy tâm thu hỗn loạn và dòng chảy tâm trương khi DA chưa đóng (Hình 1). Đối với mặt trên ức, đầu dò phải được đặt ở đường giữa mặt phẳng sagittal để nhìn thấy động mạch phổi ở bên trái và động mạch chủ xuống ở bên phải của hình ảnh. DA xuất hiện giữa hai động mạch lớn (Hình 2).

Hình 1: Ống động mạch ở mặt cắt cạnh ức trục ngắn. (A) Hình ảnh 2D mặt cắt cạnh ức trục ngắn, (B) hình ảnh với Doppler màu, (C) Doppler trong thân động mạch phổi với ống động mạch đã đóng và (D) Doppler trong thân động mạch phổi với ống động mạch chưa đóng. MPA, thân động mạch phổi; RPA, động mạch phổi phải; LPA, động mạch phổi trái; AAo, động mạch chủ lên.
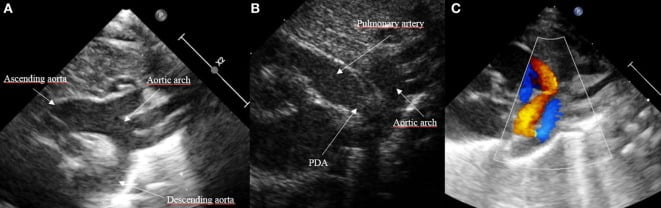
Hình 2: PDA ở mặt cắt trên ức. (A) Mặt cắt trên ức của cung động mạch chủ bình thường, (B) Mặt cắt sagittal trên ức của động mạch phổi và động mạch chủ xuống, và (C) Doppler màu với PDA màu đỏ.
Bên cạnh các mặt cắt cạnh ức và trên ức, cũng có thể để xem DA ở mặt cắt cạnh ức trục dài bằng cách di chuyển đầu dò từ tư thế cạnh ức trục dài cổ điển về phía trước hướng về phía động mạch phổi (Hình 3). Tư thế dưới sườn cũng cho phép phát hiện DA. Mặt phẳng duy nhất không thích hợp để phát hiện DA là mặt phẳng bốn buồng.
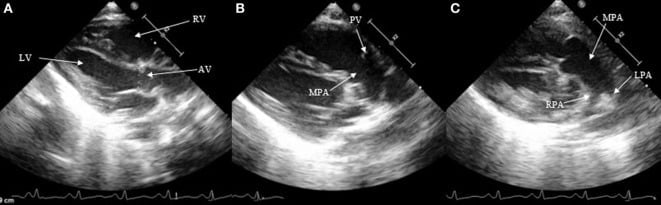
Hình 3: Ống động mạch với mặt cắt cạnh ức trục dài. (A) Mặt cắt cạnh ức trục dài cổ điển trên chế độ 2D, (B) Mặt cắt trục dài hơi chếch về phía trước hướng về phía động mạch phổi, và (C) thân động mạch phổi với các nhánh. RV, tâm thất phải; LV, tâm thất trái; AV, van động mạch chủ; PV, van động mạch phổi; MPA, thân động mạch phổi; RPA, động mạch phổi phải; LPA, động mạch phổi trái.
Kích thước ống động mạch
Mặt phẳng chính xác nhất để đo kích thước của DA là mặt cắt trên ức phía bên trái, còn được gọi là mặt cắt xem ống động mạch. Tập trung vào thân động mạch phổi, gốc của động mạch phổi phải không phải lúc nào cũng có thể nhìn thấy và động mạch phổi trái có thể được nhìn thấy; DA ở vị trí bên trái của nó. DA nên được đo tại điểm hẹp nhất, trước khi nhập nó vào thân động mạch phổi (Hình 4).
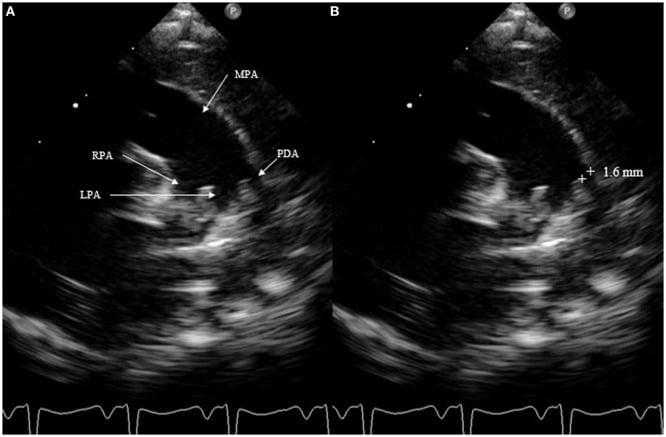
Hình 4: Đo kích thước ống động mạch trên mặt cắt trên ức. MPA, thân động mạch phổi; RPA, động mạch phổi phải; LPA, động mạch phổi trái.
Đo kích thước ống động mạch không chính xác lắm. Không nên sử dụng Doppler màu, có thể phóng đại kích thước. Các phép đo phải luôn được thực hiện bằng cách sử dụng một kỹ thuật phù hợp. Một PDA được coi là nhỏ ở mức <1,5mm, vừa phải khi nó nằm trong khoảng từ 1,5 đến 3mm và lớn nếu kích thước vượt quá 3mm. Không nên chọn mặt cắt cạnh ức trục ngắn để đo kích thước ống vì không phải lúc nào cũng có thể phân biệt động mạch phổi trái với DA.
Hướng của dòng chảy ở PDA
Hướng của dòng chảy PDA có thể từ phải sang trái, hai chiều hoặc trái sang phải. Để đánh giá được nó, Doppler màu là bắt buộc. Một shunt từ phải sang trái qua PDA khó nhìn thấy hơn: Doppler màu sẽ cho thấy một dòng chảy từ động mạch phổi đến động mạch chủ xuống. Do đó, cả hai động mạch lớn và DA sẽ xuất hiện màu xanh trên Doppler màu vì máu di chuyển ra khỏi đầu dò. Đặt Doppler xung trên DA cho thấy sóng Doppler bên dưới đường cơ sở, thường là trong thì tâm thu. Ít thường xuyên hơn, một dòng chảy liên tục trong thì tâm thu và tâm trương có thể quan sát thấy, đại diện cho một shunt thuần nhất từ phải sang trái (Hình 5). Khi trở kháng mạch máu phổi thấp xuống, shunt sẽ có hai chiều với lưu lượng trên đường cơ sở ở thì tâm thu và dưới đường cơ sở trong thì tâm trương (Hình 6). Vận tốc thường thấp và cho thấy áp lực bằng nhau trong động mạch phổi và động mạch chủ xuống. Doppler màu hiển thị xen kẽ màu đỏ và màu xanh. Khi trở kháng phổi giảm hơn nữa, shunt sẽ từ trái sang phải và xuất hiện màu đỏ trên Doppler màu. Trên Doppler xung hoặc liên tục, có thể đo vận tốc cực đại trong khi tâm thu và tâm trương. Nó cũng có thể dùng để chứng minh hướng shunt trên chế độ Doppler màu và sử dụng M-Mode (Hình 6).
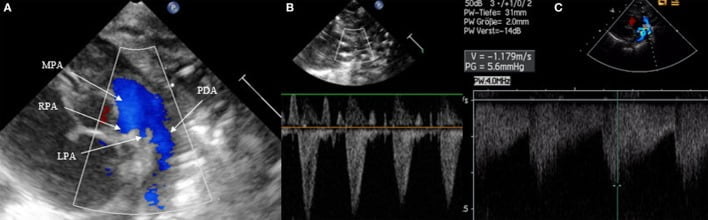
Hình 5: Shunt từ phải sang trái qua ống động mạch. (A) Mặt cắt trục ngắn, mô hình dòng chảy trên Doppler màu có màu xanh ở thì tâm thu và tâm trương, (B) dòng chảy của PDA nằm dưới đường cơ sở trong tâm thu và (C) nằm dưới đường cơ sở trong thì tâm thu và tâm trương trong trường hợp dòng chảy từ phải sang trái đơn thuần. MPA, thân động mạch phổi; RPA, động mạch phổi phải; LPA, động mạch phổi trái.
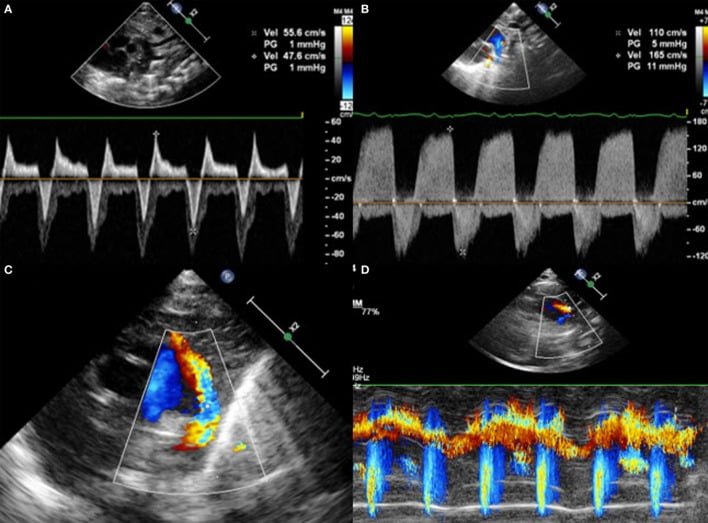
Hình 6: Mặt cắt trên ức với với (A) shunt hai chiều, (B) shunt hai chiều chủ yếu từ trái sang phải, (C) shunt từ trái sang phải trên Doppler màu và (D) shunt từ trái sang phải trên chế độ Doppler M-mode.
PDA có ý nghĩa huyết động (hsPDA)?
Ở trạng thái sinh lý, tỷ lệ lưu lượng tuần hoàn phổi và hệ thống (Qp:Qs) bằng 1. Lưu lượng thất phải phản ánh lưu lượng máu toàn thân trong khi lưu lượng thất trái phản ánh lưu lượng máu của phổi. Các shunt qua lỗ bầu dục ảnh hưởng đến dòng ra tâm thất phải, và shunt trên PDA ảnh hưởng đến dòng ra tâm thất trái. Do đó, các phép đo dòng ra của tâm thất ở trẻ sơ sinh có DA và lỗ bầu dục chưa đóng là không chính xác.
Trong trường hợp hsPDA, lưu lượng máu phổi tăng lên do lượng máu chảy ngược từ động mạch chủ xuống vào tuần hoàn phổi thông qua PDA; mô hình này được gọi là hiện tượng cắp máu. Đồng thời, lưu lượng máu hệ thống giảm vì cùng một lý do. Tỷ lệ Qp:Qs sẽ tăng.
Không có định nghĩa lâm sàng rõ ràng về hsPDA. Sosenko và cộng sự [6] đã đề cập đến hsPDA khi có dấu hiệu lâm sàng của PDA liên quan đến xuất huyết phổi, hoặc với bệnh cơ tim và các dấu hiệu phù phổi, cũng như suy hô hấp hoặc hạ huyết áp cần điều trị bằng thuốc vận mạch. McNamara và Sehgal [7] đã đề xuất một phân loại hệ thống với sự so sánh giữa các tiêu chí lâm sàng và siêu âm tim ở hsPDA.
Các tiêu chí siêu âm tim chính được đề cập trong y văn bao gồm giãn tâm nhĩ trái với tỷ lệ tâm nhĩ trái và động mạch chủ (LA: Ao) ≥1,5, và không có hoặc đảo ngược dòng chảy tâm trương trong động mạch chủ xuống, không có hoặc đảo ngược dòng chảy động mạch mạc treo tràng trên và / hoặc trong động mạch não trước, đường kính PDA từ vừa đến lớn (≥1,5mm) tại điểm hẹp nhất và dòng chảy trên Doppler xung không giới hạn [2, 5, 6, 8-12].
Làm thế nào chúng ta có thể đo các thông số này?
Tỷ lệ LA:Ao được đo trên mặt cắt cạnh ức trục dài sử dụng M-Mode (Hình 7). Mặt cắt được thực hiện ở nhĩ trái ở mức van động mạch chủ, với đầu dò được đặt vuông góc với nó. Van động mạch chủ được đo ngay trước khi mở, ở cuối thì tâm trương, trong khi nhĩ trái được đo ở thể tích tối đa trong thì tâm thu. Tỷ lệ LA:Ao không được vượt quá 1,5. Phép đo này dễ thực hiện nhưng không chính xác vì hai lý do: thứ nhất, nhĩ trái không phải lúc nào cũng dễ phân định, đặc biệt là do sự nhập của các tĩnh mạch phổi vào nó. Thứ hai, shunt ở tâm nhĩ ảnh hưởng đến tỷ lệ LA:Ao vì một lỗ lớn bầu dục hoặc khuyết vách tâm nhĩ sẽ dẫn đến nhĩ trái bị rỗng vào bên phải.
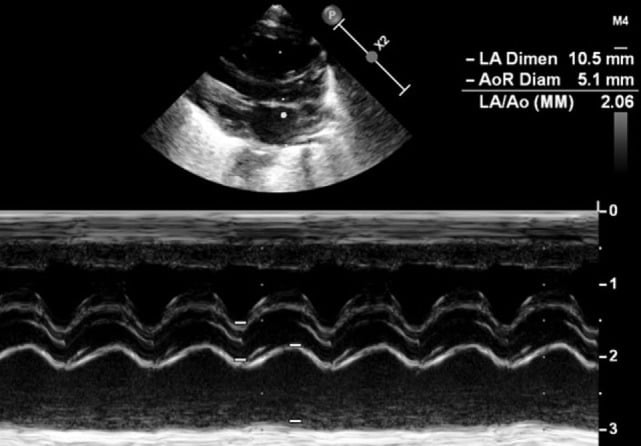
Hình 7: Đo tỷ lệ LA:Ao ở mặt cắt cạnh ức trục dài trong chế độ M-mode.
Một dấu hiệu nữa của hsPDA là dòng tâm trương không có hoặc đảo ngược trong động mạch chủ xuống. Để hình dung điều này, đầu dò phải được đặt ở động mạch chủ xuống; Doppler xung cần được sử dụng. Trong trường hợp sinh lý, sóng Doppler ở vị trí phía trước trong thì tâm thu và tâm trương, với sóng nhìn thấy ở dưới đường cơ sở. Khi hiện tượng cướp máu xuất hiện, dòng chảy cuối tâm trương sẽ vắng mặt, và nếu tỷ lệ Qp:Qs tăng hơn nữa, dòng chảy sẽ bị thoái lui trong suốt kỳ tâm trương, xuất hiện trên đường cơ sở (Hình 8). Phép đo này là một trong những cách cụ thể nhất để đánh giá hsPDA.
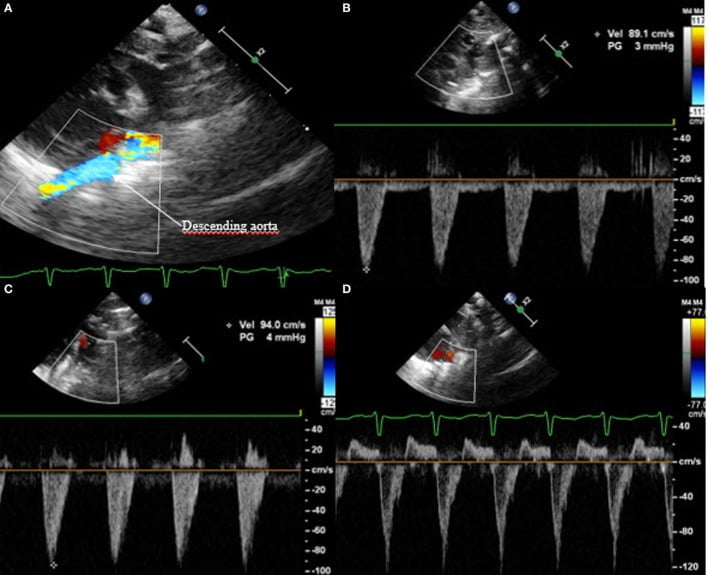
Hình 8: Mặt cắt trên ức: (A) Doppler màu sau ống động mạch ở động mạch chủ xuống với (B) dòng chảy trước bình thường, (C) không có dòng chảy cuối tâm trương và (D) dòng chảy ngược.
Theo cách tương tự, lưu lượng tâm trương được đo ở động mạch chủ xuống đoạn bụng và trong động mạch mạc treo tràng trên. Một lần nữa, dòng tâm trương phải ở phía trước và được nhìn thấy như một đường cong Doppler phía trên đường cơ sở. Trong trường hợp của hsPDA, nó có thể vắng mặt hoặc thậm chí xuất hiện dòng đảo ngược (Hình 9). Trong trường hợp này, tưới máu của ruột non có thể bị tổn hại.
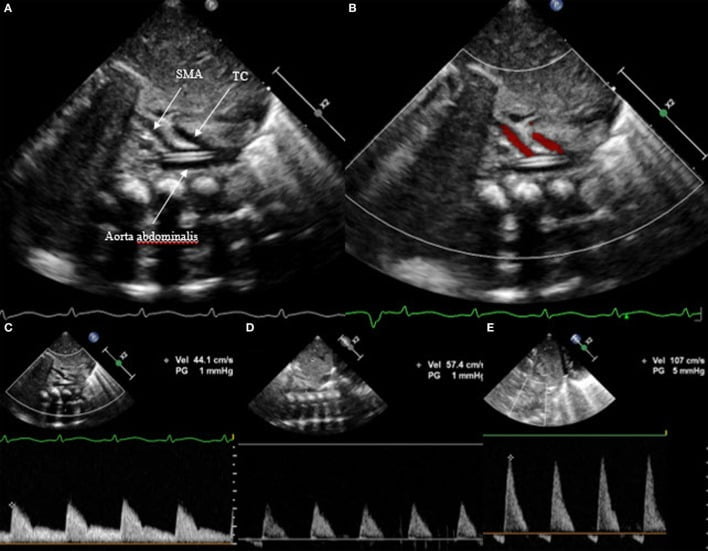
Hình 9: Mặt cắt dưới sườn của động mạch chủ xuống đoạn bụng với động mạch thân tạng và động mạch mạc treo tràng trên, (A) trên 2D, (B) trên Doppler màu, (C) dòng chảy phía trước, (D) vắng mặt dòng chảy cuối tâm trương, và (E] dòng chảy ngược. TC, động mạch thân tạng; SMA, động mạch mạc treo tràng trên.
Cuối cùng nhưng không kém phần quan trọng, mẫu lưu lượng Doppler trên PDA cần được đo. Điều này sẽ hiển thị một trong ba dạng (Hình 10). PDA không có ý nghĩa huyết động có tốc độ dòng chảy cao trong thì tâm thu và tâm trương với vận tốc tối đa trên 2m/s ở thì cuối tâm trương; đây được gọi là dòng qua ống liên tục bị hạn chế (trở kháng thấp). Nếu PDA có ý nghĩa huyết động vừa phải, mô hình dòng chảy Doppler có tốc độ tâm trương tối đa dưới 2m/s và được gọi là dòng qua ống theo nhịp không hạn chế (trở kháng cao). PDA có ý nghĩa huyết động lớn, dòng chảy cũng là một dòng qua ống theo nhịp không hạn chế, nhưng tốc độ cuối tâm trương tối đa là dưới 1m/s (trở kháng cao). Bên cạnh các giá trị tuyệt đối, cũng có thể đo tỷ lệ giữa vận tốc tâm thu và tâm trương. Nếu tốc độ đỉnh tâm trương cao hơn 50% tốc độ đỉnh tâm thu, mô hình dòng chảy bị hạn chế (trở kháng thấp). Nếu tỷ lệ này nhỏ hơn 50%, dạng dòng chảy là có nhịp (trở kháng cao) gợi ý PDA có ý nghĩa huyết động.
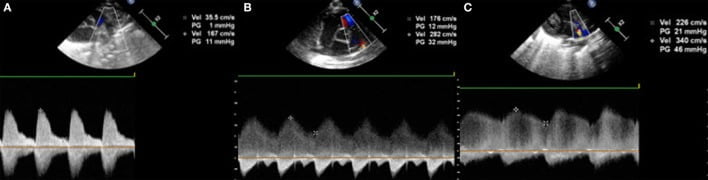
Hình 10: Lưu lượng qua ống động mạch trên Doppler trong mặt cắt cạnh ức trục ngắn hoặc mặt cắt trên ức (A, B) dòng chảy có nhịp không hạn chế và lưu lượng liên tục hạn chế (C).
3.3. Tóm tắt các thông số siêu âm tim của PDA
Các thông số siêu âm tim đặc hiệu nhất của PDA có thể được chia thành ba nhóm: (i) các đặc điểm ống động mach, (ii) quá tải tuần hoàn phổi và (iii) giảm tuần hoàn hệ thống. Hai cái sau được quan sát thấy trong trường hợp hsPDA.
Đặc điểm của PDA
Các đặc điểm của PDA được đánh giá tốt nhất bằng cách đo kích thước ống động mạch và vận tốc qua DA, ở cả hai mặt cắt. Đường kính ống động mạch đo được trong ngày đầu tiên sau sinh có độ nhạy và độ đặc hiệu cao trong việc dự đoán sự phát triển của hsPDA [2]. Các tác giả khác cũng mô tả mối liên quan giữa kích thước PD và sự cần thiết phải đóng PD bằng thuốc hoặc phẫu thuật [13]. Đo vận tốc dòng chảy từ mặt cắt trên ức cung cấp thông tin về hướng của dòng chảy và cho phép đánh giá áp lực phổi. Hơn nữa, định lượng vận tốc dòng tâm thu và tâm trương qua PDA và đặc biệt là tỷ lệ vận tốc dòng đỉnh tâm thu và đỉnh cuối tâm trương là một yếu tố dự báo tốt của ống động mạch ở trẻ sinh non trước 32 tuần tuổi thai [14].
Tăng tưới máu phổi
Tăng tưới máu phổi được ghi nhận tốt nhất với tỷ lệ LA:Ao là ≥1,5, lưu lượng trung bình tăng qua động mạch phổi, lưu lượng tâm trương tăng trong động mạch phổi trái và tỷ lệ E/A hai lá >1,5 cho thấy quá tải tim trái nặng [2, 7]. Thông số siêu âm tim phổ biến nhất là tỷ lệ LA:Ao rất dễ đo. Tuy nhiên, tham số này bị ảnh hưởng bởi shunt của lỗ bầu dục.
Giảm tưới máu tuần hoàn hệ thống
Giảm tưới máu toàn thân được đánh giá tốt nhất với sự hiện diện của dòng chảy ngược trong động mạch chủ xuống cũng như ở động mạch não trước và các động mạch mạc treo tràng trên.
Các tham số này giúp phân loại PDA là không có triệu chứng, hoặc có ý nghĩa huyết động mức độ nhẹ, vừa phải hoặc nghiêm trọng. Các tài liệu không đồng ý về các thông số tốt nhất để đánh giá tầm quan trọng của còn ống động mạch có ý nghĩa, nhưng Condo và cộng sự đề xuất kích thước ống động mạch và mô hình dòng chảy được cho là có độ nhạy nhất [9]. Tuy nhiên, các thông số này phải liên quan đến các triệu chứng lâm sàng được biểu hiện của trẻ cũng như độ tuổi sau sinh của trẻ. Sự chuyển đổi huyết động, đặc trưng bởi sức cản mạch máu phổi, sẽ được phản ánh trên siêu âm tim bởi một shunt chủ yếu từ phải sang trái trong những phút đầu tiên của cuộc sống, sau đó là một shunt hai chiều và sau đó là shunt từ trái sang phải với vận tốc thấp trong ống [15]. Với việc hạ thấp sinh lý và bình thường hóa áp lực phổi, sự gia tăng vận tốc tâm thu và tâm trương được quan sát thấy. Ngoài ra, kích thước ống được đo trong 2 ngày đầu đời là một yếu tố dự báo tốt về sự tiến triển của DA có triệu chứng, điều này không xảy ra sau này trong cuộc sống. Do đó, cách tiếp cận được sử dụng để đánh giá hsPDA thay đổi tùy theo thời gian của siêu âm.
4. Thảo luận
Đánh giá siêu âm tim của PDA ở trẻ rất thiếu tháng là một trong những hoạt động hàng ngày trong một đơn vị chăm sóc đặc biệt cho trẻ sơ sinh và thường được thực hiện bởi không chỉ các Bác sĩ Tim mạch nhi mà còn bởi các Bác sĩ Sơ sinh hoặc Bác sĩ chuyên khoa Nhi được đào tạo về siêu âm tim. Thật không dễ dàng để thực hiện siêu âm tim ở trẻ cực kỳ non tháng, và thực tế là có sự biến đổi ở trẻ cũng như người quan sát là không tối ưu. Vì vậy, điều quan trọng là phải tuân theo một số quy tắc cơ bản. Đầu tiên, siêu âm tim chỉ có thể tập trung vào PDA sau khi siêu âm tổng quát hoàn chỉnh trước đó đã loại trừ bệnh tim bẩm sinh về cấu trúc và đo chức năng tâm thất. Thứ hai, việc siêu âm một trẻ sơ sinh non tháng có thể là một thách thức và việc đánh giá PDA rất tốn thời gian, do đó, điều quan trọng là phải ghi nhớ những xem xét chung được mô tả trong bài tổng quan này.
Nếu siêu âm tim trẻ sinh non với PDA đã được thực hiện bởi Bác sĩ Sơ sinh hoặc Bác sĩ chuyên khoa, thì kết quả siêu âm tim phải được xác nhận bởi Bác sĩ Tim mạch nhi và cần đưa ra quyết định chung về việc điều trị PDA và theo dõi trẻ.
Cuộc tranh luận về việc có nên can thiệp với PDA hay không nằm ngoài phạm vi của đánh giá hiện tại. Tuy nhiên, nhiều tác giả đề nghị chỉ điều trị cho trẻ sơ sinh bị hsPDA và có dấu hiệu suy lâm sàng. Thật vậy, một em bé đang rất tốt và không cần hỗ trợ máy thở hoặc oxy bổ sung thường sẽ không được hưởng lợi từ việc đóng ống động mạch. Theo nghĩa này, việc đánh giá siêu âm tim của PDA phải đi kèm với định nghĩa về ý nghĩa lâm sàng của nó. Một cách tiếp cận theo hệ thống đã được xuất bản 10 năm trước bởi McNamara và Sehgal [7], đưa ra mối tương quan chi tiết giữa các dấu hiệu lâm sàng và siêu âm tim. Các Bác sĩ sơ sinh có thể thấy điều này hữu ích trong việc quyết định xem và khi nào bắt đầu điều trị bằng thuốc để đóng PDA.
5. Tham khảo
0. Arlettaz R. (2017). Echocardiographic Evaluation of Patent Ductus Arteriosus in Preterm Infants. Frontiers in pediatrics, 5, 147. doi:10.3389/fped.2017.00147
1. Bose CL, Laughon MM. Patent ductus arteriosus: lack of evidence for common treatments. Arch Dis Child Fetal Neonatal Ed (2007) 92:F498–502.10.1136/adc.2005.092734
2. Heuchan AM, Clyman RI. Managing the patent ductus arteriosus: current treatment options. Arch Dis Child Fetal Neonatal Ed (2014) 99:F431–6.10.1136/archdischild-2014-306176
3. Rolland A, Shankar-Aguilera S, Diomandé D, Zupan-Simunek V, Boileau P. Natural evolution of patent ductus arteriosus in the extremely preterm infant. Arch Dis Child Fetal Neonatal Ed (2015) 100:F55–8.10.1136/archdischild-2014-306339
4. Benitz WE. Treatment of persistent patent ductus arteriosus in preterm infants: time to accept the null hypothesis? J Perinatol (2010) 30:241–52.10.1038/jp.2010.3
5. Kluckow M, Jeffery M, Gill A, Evans N. A randomised placebo-controlled trial of early treatment of the patent ductus arteriosus. Arch Dis Child Fetal Neonatal Ed (2014) 99:F99–104.10.1136/archdischild-2013-304695
6. Sosenko IRS, Fajardo MF, Claure N, Bancalari E. Timing of patent ductus arteriosus treatment and respiratory outcome in premature infants: a double-blind randomized controlled trial. J Pediatr (2012) 160:929–35.10.1016/j.jpeds.2011.12.031
7. McNamara PJ, Sehgal A. Towards rational management of the patent ductus arteriosus: the need for disease staging. Arch Dis Child Fetal Neonatal Ed (2007) 92:F424–7.10.1136/adc.2007.118117
8. Sellmer A, Bjerre JV, Schmidt MR, McNamara PJ, Hjortdal VE, Host B, et al. Morbidity and mortality in preterm neonates with patent ductus arteriosus on day 3. Arch Dis Child Fetal Neonatal Ed (2013) 98:F505–10.10.1136/archdischild-2013-303816
9. Condo M, Evans N, Bellu R, Kluckow M. Echocardiographic assessment of ductal significance: retrospective comparison of two methods. Arch Dis Child Fetal Neonatal Ed (2012) 97:F35–8.10.1136/adc.2010.207233
10. Vanhaesebrouck S, Zonnenberg I, Vandervoort P, Bruneel E, Van Hoestenberghe MR, Theyskens C. Conservative treatment for patent ductus arteriosus in the preterm. Arch Dis Child Fetal Neonatal Ed (2007) 92:F244–7.10.1136/adc.2006.104596
11. Iwashima S, Ishikawa T. Quantitative, noninvasive assessment of patent ductus arteriosus shunt flow by measuring proximal isovelocity surface area on color Doppler imaging. Circ J (2014) 78:2302–8.10.1253/circj.CJ-14-0229
12. Tauzin L, Joubert C, Noel AC, Bouissou A, Moulies ME. Effects of persistent patent ductus arteriosus on mortality and morbidity in very low-birthweight infants. Acta Paediatr (2012) 101:419–23.10.1111/j.1651-2227.2011.02550.x
13. Tschuppert S, Doell C, Arlettaz-Mieth R, Baenziger O, Rousson V, Balmer C, et al. The effect of ductal diameter on surgical and medical closure of patent ductus arteriosus in preterm neonates: size matters. J Thorac Cardiovasc Surg (2008) 135:78–82.10.1016/j.jtcvs.2007.07.027
14. Smith A, Maguire M, Livingstone V, Dempsey EM. Peak systolic to end diastolic flow velocity ratio is associated with ductal patency in infants below 32 weeks of gestation. Arch Dis Child Fetal Neonatal Ed (2014) 100:F132–6.10.1136/archdischild-2014-306439
15. Van Vonderen JJ, te Pas AB, Kolster-Bijdevaate C, van Lith JM, Blom NA, Hooper SB, et al. Non-invasive measurements of ductus arteriosus flow directly after birth. Arch Dis Child Fetal Neonatal Ed (2014) 99:F408–12.10.1136/archdischild-2014-306033