Hoàng Văn Trung
Tóm tắt
Di căn nội sọ là những khối u của hệ thần kinh trung ương phổ biến nhất. Nhận định trên MRI phải bao gồm các hình ảnh T1W không và có tiêm thuốc tương phản và các hình ảnh T2/FLAIR. Chúng thường xuất hiện dưới dạng nhiều tổn thương với ngấm thuốc dạng nốt hoặc dạng viền và xung quanh phù nề. Chúng có tăng sinh mạch và không hạn chế khuếch tán ở vùng hoại tử và chứa mỡ trên MRI phổ 1H. Di căn có thể được phân biệt với các khối u nguyên phát do thiếu thâm nhiễm tế bào ác tính xung quanh khối u. Liệu pháp xạ phẫu có thể tạm thời làm tăng thể tích khối u, mặc dù điều này không có giá trị bất lợi ung thư. Ít phổ biến hơn, bệnh lý ở cột sống có thể không có triệu chứng và cần được kiểm tra bằng MRI. Những thay đổi trong phương pháp điều trị ung thư đang dẫn đến tăng tỷ lệ sống sót của bệnh nhân ung thư và cải thiện chất lượng cuộc sống, ngay cả ở những người đã bị di căn. Phương pháp chẩn đoán và điều trị di căn não đang trở thành một vấn đề ngày càng phổ biến.
Abstract
Cerebral metastases are the commonest central nervous system tumors. The MR assessment should include T1-weighted images with and without enhancement and T2/FLAIR images. They usually appear as multiple lesions with nodular or annular enhancement and are surrounded by edema. They are hypervascularized and have no restriction of their diffusion coefficient in their necrotic area and contain lipids on 1H spectroscopy. Metastases can be distinguished from primary tumors by the lack of malignant cell infiltration around the tumor. Stereotactic radiotherapy may temporarily increase tumor volume, although this is not of adverse oncological value. Less commonly, spinal disease may be asymptomatic and should be examined by MR. Changes in oncology treatments are leading to increased survival of cancer patients and improved quality of survival, even in those with metastases. The diagnostic and treatment approach to cerebral metastases is becoming an increasingly common problem.
1. Di căn nội sọ (Intracranial metastases)
1.1. Dịch tễ học (Epidemiological findings)
Di căn não (cerebral metastases) đã trở thành một vấn đề sức khỏe cộng đồng (public health problem). Những năm gần đây đã gia tăng tỷ lệ mắc bệnh vì các phương pháp điều trị ung thư được cải thiện song song với những tiến bộ trong hình ảnh y học, hiện đã cung cấp sàng lọc tối ưu cho di căn não.
Smedby [1] đã báo cáo tỷ lệ mắc di căn não tăng gấp đôi ở Thụy Điển (Sweden) trong khoảng từ 1987 đến 2006, mà không có tăng gấp đôi các trường hợp ác tính nguyên phát (primary malignancy) có liên quan.
Tỷ lệ này phụ thuộc vào loại mô học của ung thư nguyên phát: 20% đối với ung thư phổi (ung cancer), 7% đối với u hắc tố (melanoma), 6.5% đối với ung thư thận (renal cancer), 5.1% đối với ung thư vú (breast cancer) và 1.8% đối với ung thư đại trực tràng (colorectal cancer) [2] .
Tỷ lệ mắc di căn não ở bệnh nhân ung thư được ước tính là 10%.
Sự liên quan của não đòi hỏi các tế bào khối u lưu thông phải bám vào nội mô não dẫn đến xâm lấn nhu mô (invasion of the parenchyma) và sau đó phát triển tại chỗ (in situ growth). Một số yếu tố tăng sinh (proliferation factors) của di căn não đặc hiệu cho các tế bào khối u (specific to the tumor cells) và những yếu tố khác phụ thuộc vào môi trường. Dòng máu (blood flow) là một ví dụ ảnh hưởng đến vị trí của di căn não.
Bán cầu não (cerebral hemisphere) là phổ biến nhất với 80% và di căn não được ưu tiên nằm ở ranh giới chất trắng – chất xám. Tiếp theo là tiểu não (cerebellar) với 15%, sau đó là thân não (brain stem) với 3%.
Trong bối cảnh này, chúng tôi cũng sẽ xem xét sự lây lan của các khối u hệ thần kinh trung ương thông qua dịch não tủy. Trong khi những di căn được biết đến nhiều nhất với u nguyên bào tủy (medulloblastoma) hoặc u màng nội tủy (ependymoma) và yêu cầu được kiểm tra thường xuyên trong các chẩn đoán, chúng cũng điển hình nhìn thấy với u thần kinh đệm grade cao (high-grade gliomas) với ngấm thuốc quanh màng não thất (periventricular ependymal enhancement) và làm mờ (blurring) các khoảng dưới nhện (subarachnoid spaces) ở nền sọ (base of the cranium).
1.2. Các thể lâm sàng (Clinical aspects)
Đặc điểm lâm sàng chủ yếu là đau đầu vào buổi sáng lúc ban đầu (headache initially in the morning) và dần trở nên thường xuyên (becoming permanent), và có thể kết hợp với tăng áp lực nội sọ (aised intracranial pressure). Thiếu hụt thần kinh (neurological deficit) và suy giảm chức năng nhiều hơn (deterioration of higher functions) cũng có thể là đặc điểm của tổn thương thứ phát (secondary disease).
Di căn não cũng có thể thầm lặng (silent) và được phát hiện trong khi đánh giá giai đoạn thường kỳ (routine staging assessment) cho một khối u nguyên phát (primary tumor).
1.3. Hình ảnh di căn não (Imaging cerebral metastases)
Các điều tra chẩn đoán hình ảnh có thể là một phần của sự đánh giá giai đoạn định kỳ đối với một khối u ác tính đã biết hoặc được sử dụng khi di căn được phát hiện là đặc tính của ung thư. Mặc dù chụp CT vẫn được sử dụng để sàng lọc di căn não, nhưng MRI rõ ràng dường như là công cụ phát hiện di căn có độ nhạy cao nhất.
Di căn trong nhu mô não (Hình 1) là phổ biến nhất, thường xuất hiện như nốt giảm tín hiệu trên T1W và tăng tín hiệu trên T2 / FLAIR, với ngấm thuốc dạng viền hoặc dạng nốt bao quanh bởi dấu hiệu phù nề dạng ngón tay đeo găng (finger gloves) thường không cân xứng với tổn thương (Hình 2).
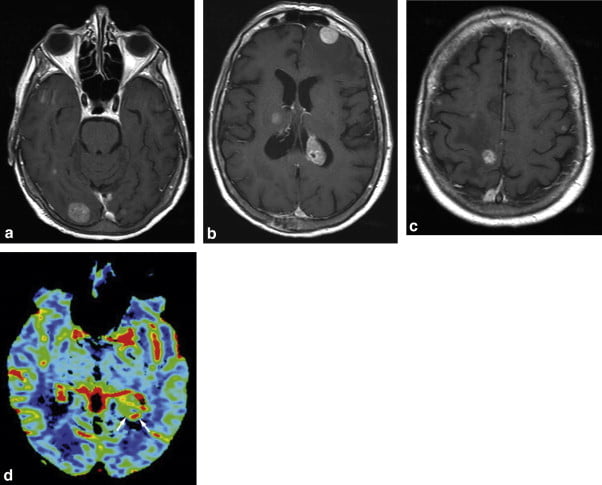
Hình 1. MRI T1 axial có tiêm thuốc tương phản (a, b, c) và bản đồ lưu lượng máu não (cerebral blood volume mapping) (d): cho thấy nhiều tổn thương hình tròn có ngấm thuốc mạnh. Đây là những tổn thương giàu mạch (hypervascular) trên bản đồ lưu lượng máu não, gợi ý bệnh lý thứ phát.
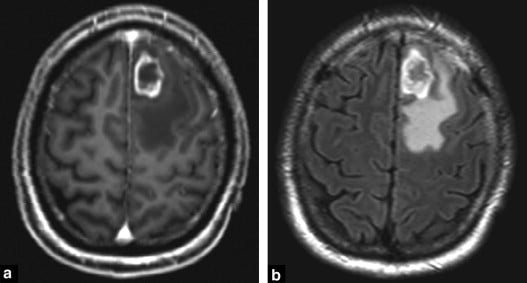
Hình 2. Di căn ở thùy trán trái từ một ung thư phổi, ngấm thuốc dạng viền (a) bao quanh bởi phù nề nhiều dạng ngón tay đeo găng nhìn thấy rõ ràng trên hình ảnh FLAIR (b). Phù nề nhiều là một đặc điểm thông thường của di căn.
Kỹ thuật pha sớm cộng hưởng từ tưới máu (first-pass perfusion) cho thấy tỷ số thể tích máu não (cerebral blood volume ratio): rCBV = CBV di căn / CBV chất trắng lành CBV (rCBV= CBV metastases/CBV healthywhitematter), được tăng lên tới 2 hoặc cao hơn [3]. Giá trị trung bình (average values) phụ thuộc vào hình ảnh chuỗi xung được sử dụng (imaging sequence used), sức mạnh của từ trường (power of magnetic field) và sự hiện diện của máu và vôi hóa cản trở nghiên cứu tưới máu do có nhiều ảnh giả cảm từ (magnetic susceptibility artifacts).
Trên MRI phổ 1H (Hình 3), di căn cho thấy tăng choline và giảm N-acetylaspartate (NAA) trong khi có một lượng lớn lipid (phổ cộng hưởng tập trung ở mức 0.9 và 1.3 ppm) và đặc biệt là lactate (cặp đôi tập trung ở 1.3 ppm) nếu hoại tử hiện diện.
Kỹ thuât pha sớm là một trong những pha của kỹ thuật MRI hình ảnh động (cine-MRI) – MRI tưới máu có tiêm adenosine (first-pass perfusion CMR, with adenosine) – MRI tưới máu lúc nghỉ (rest – perfusion MRI) và hình ảnh tăng tương phản muộn (delayed hyperenhancement imaging).
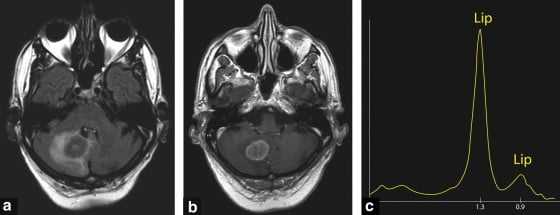
Hình 3. Di căn tiểu não phải đơn độc (single right cerebellar metastasis) được bao quanh bởi phù (a và b) chứa một lượng lớn lipid được thấy trên cộng hưởng từ phổ TE dài tập trung ở 1.3 ppm và một phổ cộng hưởng khác tập trung ở 0.9 ppm.
Các hình ảnh khuếch tán (Diffusion-weighted images) được sử dụng để kiểm tra tế bào khối u và loại trừ áp xe sinh mủ (Hình 4), vì tổn thương nhu mô có thể xuất hiện những cách khác nhau tùy thuộc liệu nốt tổn thương là nốt đặc hay có mức độ hoại tử và nang nhiều hay ít.
Hình 4. Di căn có thể dưới nhiều cách biểu hiện (metastases may take on all guises): trong trường hợp này tổn thương xuất hiện dạng nang với sự ngấm thuốc rất nhẹ ngoại vi (very slight peripheral enhancement) trên hình ảnh sau tiêm thuốc (a); các tổn thương rất tăng tín hiệu (very hyperintense) trên T2W (b), với có sự gia tăng hệ số khuếch tán (diffusion coefficient) (c) loại trừ khả năng do nguyên nhân nhiễm trùng (excluding the possibility of infectious causes).
Có vài sự xuất hiện có thể hướng đến nguồn gốc của tổn thương ác tính nguyên phát. Di căn từ từ u hắc tố (melanoma) có thể tăng tín hiệu trên hình ảnh T1W không tiêm thuốc (Hình 5) do hậu quả của sự lắng đọng melanin (melanin deposition) hoặc xuất huyết (hemorrhage). Di căn xuất huyết (hemorrhagic metastases) thường liên quan đến ung thư biểu mô tế bào nuôi (choriocarcinoma cancer) và ung thư thận (renal cancer). Xuất hiện dạng nang thường thấy trong di căn của ung thư biểu mô tuyến (adenocarcinoma) (phổi, đại tràng và vú…). Các khối u rất giàu mạch (very hypervascular tumors) trên hình ảnh tưới máu hướng tới các tổn thương thứ phát của u hắc tố (melanoma) hoặc ung thư biểu mô tuyến thận (renal adenocarcinoma) [4] .

Hình 5. Di căn từ u hắc tố có thể tín hiệu cao trên chuỗi xung T1W không tiêm thuốc: cho thấy những nốt di căn nhỏ (nodular micrometastases).
Thiếu sót thần kinh đột ngột (sudden neurological deficit) đôi khi được giải thích bởi xuất huyết trong di căn (hemorrhage within a metastases) (Hình 6).
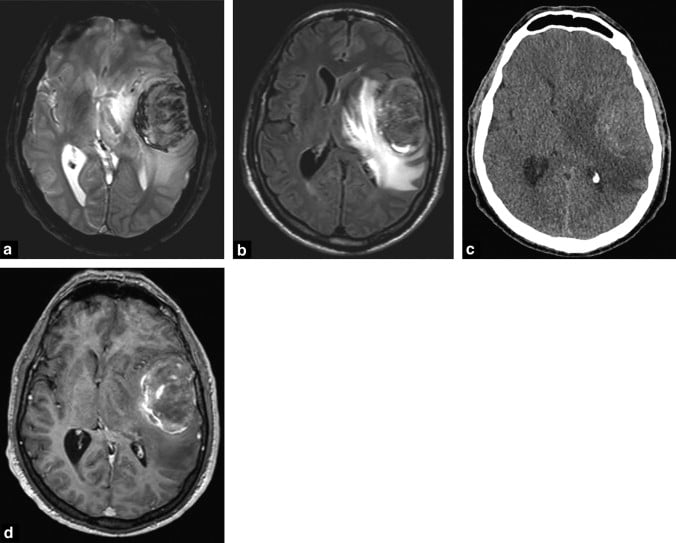
Hình 6. Thiếu sót thần kinh đột ngột khổi phát ở một người đàn ông 65 tuổi không có tiền sử bệnh lý. Bệnh nhân trên lâm sàng nghi ngờ bị tai biến mạch máu não (cerebrovascular) và được chụp kiểm tra với mục đích điều trị tan huyết khối. Hình ảnh đánh giá cho thấy một khối máu tụ trên hình ảnh T2W GRE (a) được bao quanh bởi phù nhiều trên hình ảnh FLAIR (b). CT lúc 24 giờ (c) cho thấy tổn thương tăng nhẹ tỷ trọng, nên tổn thương được nghi ngờ với chẩn đoán khối tụ máu. MRI T1 GRE 3D tiêm thuốc tương phản (d) được thực hiện sau khi chụp CT, biểu biện với ngấm thuốc ngoại vi. Đây là một di căn đơn độc (single metastasis) từ ung thư biểu mô tuyến phổi (ung adenocarcinoma) biểu hiện với xuất huyết trong u (hemorrhage within the tumor).
Di căn màng não (meningeal metastases) (Hình 7) chiếm khoảng 10% di căn nội sọ (intracranial metastases). Chúng phức hợp gồm các cả khối u đặc, bệnh bạch cầu và u lympho (These complicate both solid tumors, leukemias and lymphomas). Biểu hiện điển hình là ngấm thuốc dạng cuộn (gyriform) tạo ra một vùng ngấm thuốc tương ứng với vị trí màng não. Những tổn thương này được nhìn thấy cả ở lồi não (convexity) và nền sọ (base of the cranium) và có thể gây não úng thủy (hydrocephalus) (Hình 8) do chèn ép các khoang dưới nhện (subarachnoid spaces). Dạng tổn thương khác được nhìn thấy là dạng nốt (nodular form) với sự lan rộng của các tế bào khối u dọc theo dịch não tủy (tumor cells along the cerebrospinal fluid).
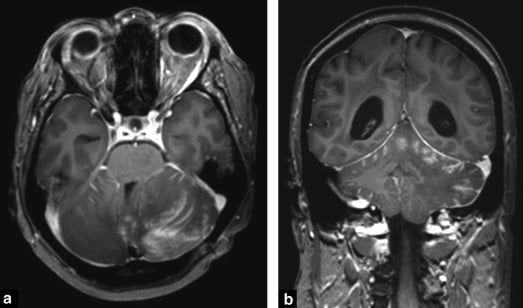
Hình 7. Tổn thương màng não ở tiểu não phức tạp từ ung thư vú, có thể thấy rõ trên các hình ảnh T1W có thuốc tương phản (a và b).

Hình 8. Bệnh nhân nữ được kiểm tra theo dõi với ung thư vú, di căn phổi và gan, có biểu hiện đau đầu (headaches). Hình ảnh FLAIR (a) cho thấy não thất giãn (ventricular dilatation) với các dấu hiệu của sự tái hấp thu qua màng não tủy (signs of transependymal resorption). Các hình ảnh T1W axial xóa mỡ (fat suppression) sau tiêm gadolinium (b và c) cho thấy ung thư biểu mô màng não (meningeal carcinomatosis) ở nền sọ (base of the cranium) với sự ngấm thuốc nhẹ của thùy nhộng trên (superior vermis) và hai bó dây thần kinh mặt-thính giác (two auditory-facial nerve bundles).
Di căn màng cứng (dural metastases) (Hình 9) hiếm hơn và thường liên quan đến tổn thương xương kéo dài vào màng cứng. Trong một số trường hợp, bệnh lý kép (dual disease) chiếm ưu thế, đôi khi dẫn đến chẩn đoán không chính xác là u màng não (meningioma). MRI phổ (Spectroscopy) rất hữu ích trong trường hợp này vì trong u màng não, phổ chỉ chứa choline trong khi phổ lipid được nhìn thấy với di căn (Hình 10).
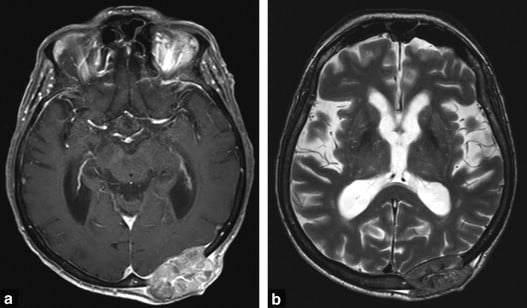
Hình 9. Di căn xương khối lớn ở vùng đỉnh chẩm (parieto-occipital) trái, với mở rộng ra dưới da (subcutaneously) và vào màng nàng não biểu hiện như một khối có ngấm thuốc (a) với các giới hạn ranh giới rõ ràng (clearly demarcated borders) và không có phù nề bên dưới tổn thương trên hình ảnh T2W (b).
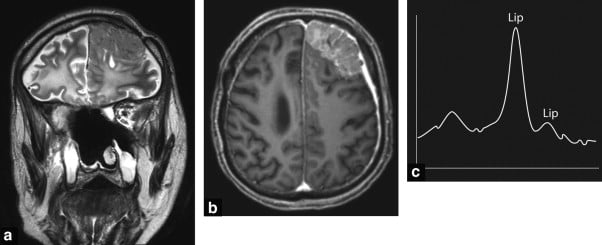
Hình 10. Động kinh cấp tính (acute epilepsy) ở một bệnh nhân có tiền sử ung thư biểu mô xoang sàng (ethmoid carcinoma). Khối lớn ngoài nhu mô não vùng trán trước trái (bulky left anterior extra-parenchymal frontal mass) đẩy lùi (pushing back) nhu mô não trên hình ảnh T2W coronal kết hợp với sự liên quan hai bên của chất trắng sau điều trị (a), ngấm thuốc tương phản mạnh trên hình ảnh T1W axial (b) có sự ngấm thuốc của màng cứng ở phía xa. MRI phổ cho thấy phổ lipid tập trung ở 1.3 và 0.9 ppm, loại trừ chẩn đoán u màng não và gới ý chẩn đoán là di căn.
Bất kể vị trí nào (regardless of site), vòm và nền sọ (vault and the base of the cranium) phải được kiểm tra để tìm các di căn xương liên quan. Trong khi cuộc kiểm tra này được chẩn đoán tốt trên CT, đôi khi nó bị bỏ qua trong các cuộc kiểm tra MRI (Hình 11).
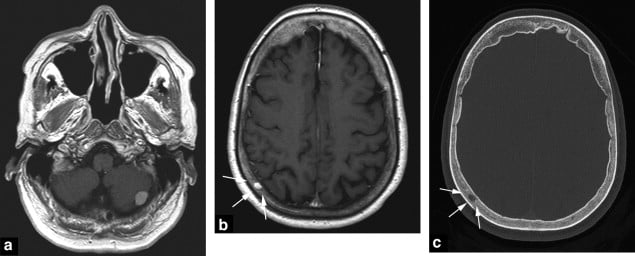
Hình 11. Đánh giá giai đoạn (staging assessment) cho u hắc tố với di căn tiểu não dưới trái (a). Lưu ý sự liên quan của xương đỉnh phải (right parietal bone) có ngấm thuốc (b) và được thấy rõ trên CT (c).
1.4. Giao thức chụp (Investigation protocol)
Kỹ thuật ưa thích hiện nay (current preferred technique) để kiểm tra di căn não là chụp cộng hưởng từ. Điều này có hai mục đích khác nhau:
Trong trường hợp tổn thương ác tính đã biết (In known malignancy), mục đích của MRI là nhận dạng và xác định tất cả vị trí của tổn thương thứ phát để quản lý bệnh nhân tối ưu (optimal patient management). Sự phát triển của kỹ thuật xạ phẫu (stereotactic radiosurgery, sử dụng dao Gamme hoặc dao Cyber) hoặc kỹ thuật xạ trị (arc-therapy, sử dụng máy gia tốc tuyến tính) cho phép chiếu xạ liều cao cục bộ tối đa 3 tổn thương dưới 3cm. Do đó, phương pháp này thay đổi cách điều trị tổn thương thứ phát, xạ trị với có hoặc không có hóa trị đi kèm (irradiation with or without chemotherapy).
Trong trường hợp tổn thương ác tính chưa biết (In unknown malignancy), mục đích của MRI là chẩn đoán chắc chắn tổn thương thứ phát, điều này có thể khó với một tổn thương duy nhất (single lesion) và được thảo luận trong đoạn “Chẩn đoán phân biệt – Differential diagnoses).
Các giao thức kiểm tra đầu tiên liên quan đến chuỗi xung T1W để nhận ra các di căn xuất huyết (hemorrhagic metastases), có tăng tín hiệu mà không ngấm thuốc. Hoặc di căn từ u hắc tố, chứa melanin và đôi khi có thể tăng tín hiệu.
Một loạt hình ảnh tiêm thuốc tương phản phải được thực hiện (a contrast-enhanced series must be taken). Liều tiêu chuẩn (standard dose) là 0.1 mmol/kg phức hợp gadolinium, hoặc 0.2 ml/kg.
Sử dụng liều gấp đôi đắt hơn nhưng xác định tốt hơn các di căn nhỏ vì nó đã được biết đến trong nhiều năm [5], liều gấp đôi hoặc thậm chí gấp ba (double or even triple dose) giúp phát hiện tốt hơn các tổn thương nhỏ. Ưu điểm của liều gấp đôi (the merits of the double dose) đã được nhấn mạnh thêm vào năm 2010 bởi KIM [6], người đã so sánh dimeglutamine gadopentate (Magnevist®) và gadobutrol (Gadovist®), cả hai đều được sử dụng với liều gấp đôi, khi đó nồng độ phân tử trong Gadovist® đã gấp đôi so với Magnevist®.
Điều quan trọng là để lại một khoảng giữa tiêm tương phản (contrast injection) và thu nhận hình ảnh (image acquisition) [5] để cho phép một thời gian trung bình thuốc tương phản khuếch tán trước khi ghi lại hình ảnh. Đây là một yếu tố rất quan trọng khi hình ảnh T1W thể tích khối (T1-weighted volume image) được ghi lại.
Vì lý do này, nên thực hiện chuỗi xung T2 / FLAIR sau khi tiêm thuốc gadolinium để chờ thuốc ngấm một vài phút trước khi chụp chuỗi xung T1W.
Điều này được thực hiện từ việc chụp khối thể tích thường ở kỹ thuật Gradient Echo, cung cấp độ tương phản tốt giữa chất trắng và chất xám và có sẵn trên hầu hết các máy MRI hoặc chụp khối thể tích ở kỹ thuật Spin Echo. Chuỗi xung này được báo cáo là có một số lợi thế cho việc phát hiện các tổn thương thứ phát [7] .
Nhiều chuỗi xung (sequences) hiện đang được phát triển để tối ưu hóa cho việc phát hiện các tổn thương ngoại vi nhỏ, bao gồm chuỗi xung Spin Echo 3D “Blood sequence), để không nhầm lẫn giữa ngấm thuốc mạch máu ngoại vi và những di căn nhỏ [8] .
Hình ảnh FLAIR phát hiện các tổn thương ở vỏ và dưới vỏ nhỏ (Hình 12).
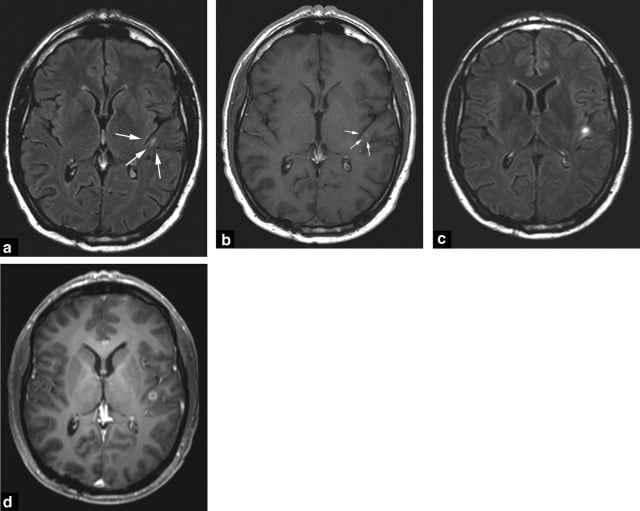
Hình 12. Hình ảnh FLAIR đặc biệt hữu ích (particularly useful) để xác định các tổn thương ở vỏ và dưới vỏ não (cortico-subcortical lesions). Trong đánh giá ban đầu của một bệnh nhân được theo dõi với ung thư phổi, một nốt nhỏ ở dưới vỏ não thùy đảo trái tăng tín hiệu (small left subcortical insular hyperintensity) được nhìn thấy trên FLAIR (a) ngấm thuốc rất nhẹ trên hình ảnh có thuốc tương phản (b). Chụp lại sớm cho thấy sự gia tăng thể tích của tổn thương trên hình ảnh FLAIR (c) và hình ảnh sau tiêm thuốc tương phản, lần này là dạng viền (annular) (d).
Một loạt hình ảnh FLAIR sau khi tiêm gadolinium cũng được hy vọng trong việc xác định tổn thương màng não, giúp giảm thời gian thư giãn T1 (T1-weighted relaxation time) để loại bỏ tín hiệu dịch não tủy (cerebrospinal fluid) và giảm tín hiệu của các mạch máu vùng vỏ não bình thường (normal cortical vessels).
Cuối cùng, Singh [9] nhấn mạnh (highlighted) rằng hình ảnh T1W có thuốc tương phản nhạy hơn FLAIR có tiêm thuốc để phát hiện di căn màng não.
Một số người [10] đề xuất một loạt hình ảnh T1W tiêm thuốc với xóa mỡ hơn là loạt hình ảnh FLAIR tiêm thuốc. Gần đây, một nhóm [11] đã nhấn mạnh tiện ích của các chuỗi xung 3D (3D sequences) sau tiêm gadolinium.
Hình ảnh nâng cao (advanced imaging) có vai trò trong các chẩn đoán khó khăn, đặc biệt là xác định một khối duy nhất ở một bệnh nhân không có tiền sử bệnh ác tính trong quá khứ.
1.5. Chẩn đoán phân biệt (Differential diagnoses)
1.5.1. Di căn với u thần kinh đệm ác tính (Metastases versus malignant glioma)
Cả hai khối u ác tính này đều có hình thái cực kỳ giống nhau (extremely similar morphologically) và cả hai đều xuất hiện dưới dạng ngấm thuốc tương phản thường dạng viền hoặc nốt (annular or nodular) được bao quanh bởi lượng lớn của phù (Hình 13). Cả hai khối u đều có tăng rCBV trên hình ảnh tưới máu, tăng choline với sự hiện diện của lactate và lipid trên MRI phổ.

Hình 13. Ngấm thuốc dạng viền của một di căn (a), phù quanh tổn thương chỉ nhìn thấy trên hình ảnh FLAIR, không có thâm nhiễm khối u (b). Ngược lại, xung quanh một u nguyên bào thần kinh đệm (glioblastoma) ở thùy trán trái có thành phần hoại tử và dạng nang (necrotic and cystic) (c), thâm nhiễm khối u (tumor infiltration) xuất hiện ở bờ sau của nó (mũi tên) và phù dạng ngón tay đeo găng (finger gloves) cũng được nhìn thấy xung quanh tổn thương (d).
Phân biệt (discriminating) giữa hai khối u đặc biệt khó khăn khi tổn thương là đơn độc và bệnh nhân không có tiền sử bệnh ác tính trong quá khứ.
Một vài biểu hiện kín đáo (some subtle appearances) gợi ý u thần kinh đệm (glial tumor). Chúng bao gồm tín hiệu cao của thâm nhiễm vào vỏ não (hyperintensity infiltrating the cortex) trên hình ảnh FLAIR [12]. Mở rộng vào thể chai (corpus callosum) hoặc dải thị (optical tract) cũng hướng tới u thần kinh đệm. Phân tích khu vực xung quanh khối u là phương pháp thích hợp nhất để chỉ ra một hoặc hai nguyên nhân khác nhau. Tăng tín hiệu trên hình ảnh FLAIR xung quanh vùng ngấm thuốc tương phản trong u thần kinh đệm phản ánh cả phù nề, sự hiện diện của các tế bào u và mao mạch khối u (tumor cells and tumor capillaries) là thâm nhiễm xung quanh tổn thương, trong khi tăng tín hiệu trên hình ảnh FLAIR xung quanh tổn thương di căn chỉ phản ánh phù vận mạch (vasogenic edema).
Sự khác biệt này được nhìn thấy trên cả hình ảnh tưới máu và phổ. Tỷ lệ rCBV quanh tổn thương xung quanh u thần kinh đệm ác tính lớn hơn so với di căn, và theo một cách tương tự, tỷ lệ Cho/Cr cao hơn xung quanh các u thần kinh đệm ác tính so với di căn [13] . Sự gia tăng myoinositol xung quanh một u thần kinh đệm ác tính cũng đã được báo cáo nhiều hơn gần đây [14]. Theo Opstad [15], một phân tích chi tiết của các phổ lipid có tỷ lệ tập trung ở 1.3 ppm và 0.9 ppm có thể phân biệt di căn với u thần kinh đệm ác tính.
CHA [16] đã kiểm tra đường cong tưới máu (perfusion curves) bằng hai tham số (two parameters): đỉnh cực đại (peak height) và tỷ lệ phần trăm phục hồi tín hiệu (percentage signal recovery). Đỉnh cực đại tương quan chặt chẽ (correlates closely) với thể tích máu não (cerebral blood volume) và cao hơn quanh một khối u lympho grade cao (high-grade lymphoma) hơn so với di căn. Phần trăm phục hồi cường độ tín hiệu thấp hơn xung quanh di căn so với xung quanh u nguyên bào thần kinh đệm (glioblastoma) phản ánh các vi mạch cao hơn. Gần đây, Ducreux [17] đã báo cáo về ích lợi của chuỗi xung T2 GRE, nó cho thấy sự gia tăng rCBV và tính thấm bất thường (increased rCBV and permeability abnormalities) (được kiểm tra bằng cách đo ΔR2 *) gần mô quanh u ở u thần kinh đệm và không phải di căn.
Trong thực tế, việc tìm thấy các khu vực tăng tưới máu trên bản đồ thể tích máu não (thu được từ kỹ thuật pha sớm của hình ảnh tưới máu) vượt ra ngoài khu vực ngấm thuốc tương phản ủng hộ u thần kinh đệm hơn là tổn thương thứ phát.
MRI đa tham số (Multiparametric MR) [18] đang phát triển để phân biệt các u thần kinh đệm grade cao với di căn. Điều này liên quan đến việc kiểm tra cấu trúc của các mô khác nhau bằng cách trích xuất các tham số như entropy và homogeneity… từ một loạt hình ảnh tưới máu. Cách tiếp cận phức tạp này dường như có triển vọng và giá trị đang được phát triển.
1.5.2. Di căn với áp xe não (Metastases versus cerebral abscess)
Ebisu [19] đã cho thấy tầm quan trọng của các chuỗi khuếch tán (diffusion-weighted sequences) để phân biệt áp xe với các khối u dạng nang hoặc hoại tử (necrotic-cystic tumors), do các ổ áp xe có hệ số khuếch tán thấp (diffusion coefficient) hơn các khối u (Hình 14).
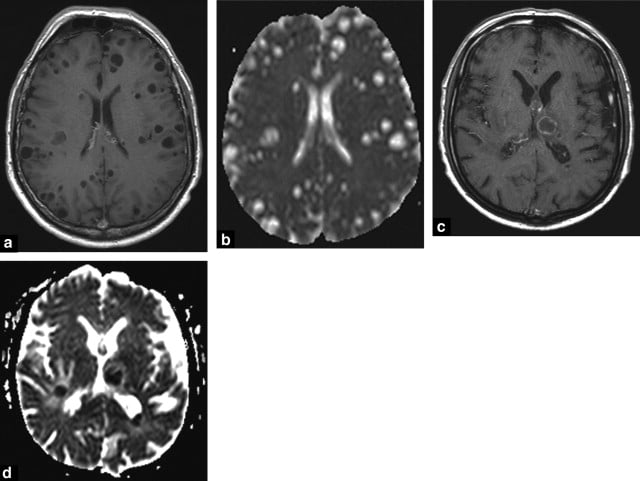
Hình 14. Thành phần lỏng của di căn dạng nang (cystic metastases) (a) có hệ số khuếch tán tăng lên tương ứng trên bản đồ ADC (b). Ngược lại, thành phần lỏng của nhiều ổ áp xe (c) có hệ số khuếch tán giảm trên bản đồ ADC (d). Do đó, các hình ảnh khuếch tán là cơ bản để phân biệt nhiều di căn với áp xe.
Kỹ thuật này tất nhiên không phải là đặc trưng bệnh lý (pathognomonic) trong chẩn đoán áp xe não mặc dù nó rất thích hợp chẩn đoán với độ nhạy (sensitivity) và độ đặc hiệu (specificity) là 96% để phân biệt áp xe não với tổn thương không phải vùng áp xe trong tổn thương. Nó có giá trị tiên đoán dương (positive predictive value) là 98% và giá trị tiên đoán âm (negative predictive value) là 92%.
Kỹ thuật khuếch tán (diffusion-weighted technique) đặc biệt có thể thất bại (fail) với các dương tính giả (false positives) như di căn xuất huyết (hemorrhagic metastases) và âm tính giả (false negatives) khi bắt đầu điều trị bằng kháng sinh (antibiotic therapy) hoặc trong áp xe do nấm (fungal abscesses).
Trong những tình huống này (these situations) có thể hữu ích khi sử dụng MRI phổ, chứng minh sự hiện diện của một đỉnh amino acid tập trung ở 0.9ppm trong áp xe sinh mủ (pyogenic abscesses) [20].
Castillo [21] đề xuất hình ảnh khuếch tán theo lực (diffusion tensor imaging, đây là kỹ thuật khuếch tán theo hướng) để tránh sự cần thiết phải phân tích bản đồ ADC.
Bản đồ của phần bất đẳng hướng (mapping of the anisotropic fraction) cho thấy sự hiện diện của một viền tăng tín hiệu (a hyperintense ring) trong 84.6% di căn và chỉ trong 13.3% áp xe. Tương tự, vùng bất đẳng hướng được đo bằng các chỉ số khác nhau (extent of anisotropism measured by various indicators) liên quan đến sự khác biệt giữa các giá trị cụ thể của bó sợi (specific values of the tensor) có thể hướng đến một hoặc các nguyên nhân khác.
Đơn giản hơn (more simply), nghiên cứu vỏ của tổn thương (capsule of the lesion) có thể giúp phân biệt giữa khối u ác tính (malignant tumors) và áp xe.
Áp xe có một vỏ bao, rất giàu collagen và nghèo mạch với rCBV gần bằng 1 [22] thường vượt qua đường cong cơ sở (curve baseline) ở kỹ thuật pha sớm.
Cuối cùng, hình ảnh nhạy từ (susceptibility imaging) [23] được sử dụng cho áp xe cho thấy hai vòng đồng tâm (two concentric rings), một vòng tăng tín hiệu và một vòng giảm tín hiệu bao quanh tổn thương. Một viền mỏng giảm tín hiệu hoàn chỉnh bên ngoài vỏ bao được cho là đại diện cho sự lắng đọng gốc tự do thuận từ (paramagnetic free radical deposits) của đại thực bào (macrophages) và vòng tăng tín hiệu bên trong phản ánh các mô hạt (granulomatous tissues), thường xuất hiện giữa trung tâm hoại tử (necrotic centre) của áp xe và vỏ sợi collagen (fibrous collagen capsule).
Mặc dù không có kỹ thuật nào trong số này là đặc biệt để xác định nhiễm trùng (infection), chẩn đoán thường có thể được thực hiện một cách thích hợp vì có nhiều kỹ thuật có sẵn (wide range of techniques available).
1.5.3. Di căn với u lympho (Metastases versus lymphoma)
U lympho não nguyên phát (primary cerebral lymphoma) xuất hiện điển hình như một dải đồng nhất (homogeneous band), tăng đậm độ trên CT không cản quang (hyperdense on unenhanced CT), giảm tín hiệu trên hình ảnh T1W ở vỏ não và giảm tín hiệu hơn trên hình ảnh T2W với sự hấp thu thuốc tương phản lớn. Trong khi một tổn thương sâu duy nhất (single deep lesion) ở thể chai (corpus callosum) cần ít thảo luận hơn, thì tổn thương nhiều vị trí có lợi từ việc kiểm tra bằng hình ảnh khuếch tán và tưới máu để phân biệt chúng với di căn.
Ung lympho (lymphoma) có mật độ tế bào cao (highly cellular) và có hệ số khuếch tán thấp (low diffusion coefficient): các mạch máu ác tính (malignant blood vessels) là hiển nhiên, có khoảng hở (fenestrated) và rCBV cao hơn một chút, gần bằng 1 vượt qua đường cong cơ sở (curve baseline) ở pha sớm trong các nghiên cứu được thực hiện ở 1.5 Tesla (Hình 15) [ 24]. Nó vượt qua đường cơ sở ít thường xuyên hơn ở 3 Tesla [25].
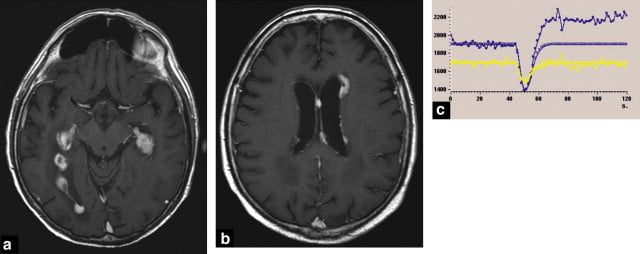
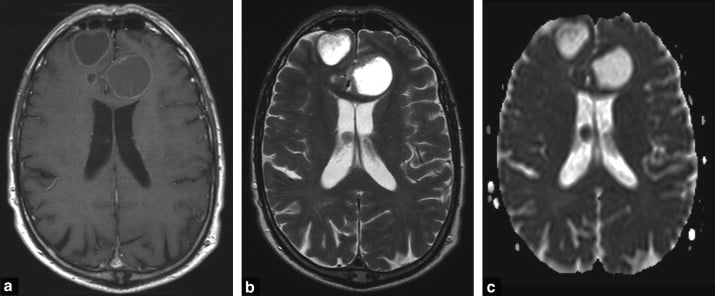
Hình 15. Nhiều tổn thương quanh não thất (multiple periventricular lesions) với sự ngấm thuốc mạnh (a và b), có tỷ lệ thể tích máu não (cerebral blood volume) là 1.5 trên đường cong tưới máu (perfusion curve) (c) và đặc biệt có những bất thường lớn rõ ràng (major patency abnormalities) được nhìn thấy vượt qua đường cơ sở của đường cong pha sớm (ROI tham chiếu, đường cong màu vàng; lymphoma, đường cong ROI màu xanh). Đây là một u lympho nguyên phát hệ thần kinh trung ương (primary central nervous system lymphoma).
Phổ điển hình (typical spectrum) là đỉnh choline kết hợp với phổ lipid tập trung ở mức 1.3 và 0.9ppm bên ngoài các vùng hoại tử (outside of necrotic areas) [26], [27]. Những phổ lipid này được cho là do sự hiện diện của nhiều đại thực bào (numerous macrophages) có chứa các giọt lipid (lipid droplets).
Các kỹ thuật tiên tiến (advanced techniques) đặc biệt hữu ích để xác định các u lympho màng não nguyên phát hoặc thứ phát (primary or secondary meningeal lymphomas).
Chẩn đoán có thể khó khăn trong ức chế miễn dịch (immunosuppression), vì khối u lympho trong trường hợp này có thể xuất hiện nhiều và hoại tử, và có thể biểu hiện rất giống với tổn thương thứ phát. Một lần nữa, phát hiện trong hình ảnh tưới máu rất có vai trò để phân biệt u lympho với di căn.
1.5. Theo dõi điều trị (Treatment follow-up)
Việc theo dõi sau điều trị di căn não thường không gây ra vấn đề gì nếu bệnh nhân được xạ trị và/hoặc hóa trị khi thể tích khối u giảm (tiêu chuẩn RECIST) phản ánh đáp ứng tích cực với điều trị.
Một vấn đề khó khăn hơn phát sinh trong việc theo dõi di căn, với chiếu xạ bằng phương pháp xạ phẫu (irradiated by radiosurgery). Gia tăng ngấm thuốc tương phản sớm có mặt trong 12% trường hợp [28]. Sự xuất hiện này được nhìn thấy đặc biệt ở những người trẻ tuổi và nếu hóa trị (chemotherapy) được kết hợp với xạ phẫu (radiosurgery).
Patel [29] đã kiểm tra thể tích u của 516 tổn thương di căn được điều trị bằng liệu pháp xạ phẫu trong 3 năm và cho thấy một phần ba các tổn thương tăng kích thước trong quá trình theo dõi. Sự gia tăng thể tích này bắt đầu từ 6 tuần sau khi xạ phẫu và có thể kéo dài đến 15 tháng sau đó. Do đó, tiêu chí về kích thước có thể không đủ để phân biệt hoại tử do xạ trị (radionecrosis) với sự tái phát của khối u (recurrence of tumor). Về mặt mô học (histologically), các phản ứng hoại tử (necrotic reactions) đã được tìm thấy liên quan đến viêm (inflammation), hiệu ứng đệm hóa (gliosis effects) và thoái hóa myelin (demyelination).
Kano [30] đề xuất rằng việc hình ảnh T1W tiêm thuốc tương phản được so sánh với sự xuất hiện của tổn thương trên hình ảnh T2W. Nếu các bờ (margins) của khối u được xác định từ hình ảnh T1W cắt qua các bờ khối u của hình ảnh T2W, thì sự xuất hiện gợi ý tái phát của khối u, trong khi nếu sự ngấm thuốc tương phản che lấp các hình ảnh bất thường, và bị mờ trên hình ảnh T2W, thì sự xuất hiện được gợi ý hoại tử do xạ trị.
Hình ảnh tưới máu cũng có vai trò trong việc theo dõi u thần kinh đêm ác tính (malignant glioma). Tăng rCBV gợi ý sự tiến triển của khối u trong khi tỷ lệ tương đối thấp gợi ý hoại tử do xạ trị (radionecrosis).
2. Di căn cột sống (Spinal metastases)
2.1. Di căn trong ống sống (Intraspinal metastases) [31]
Di căn cột sống (spinal metastases) được hiểu biết nghèo nàn và có thể xảy ra như một biến chứng của một khối u ban đầu nằm ở bên trong hoặc bên ngoài của hệ thần kinh trung ương. MRI là khám xét duy nhất nên được sử dụng để kiểm tra cho những vấn đề này. Một bài báo gần đây [32] đã phân tích các đặc điểm lâm sàng và hình ảnh học của 55 bệnh nhân: các dấu hiệu cột sống (spinal signs) là đặc điểm của bệnh ác tính ở 20% trường hợp mặc dù 8% di căn không có triệu chứng. Các tổn thương ngấm thuốc tương phản trong 98% các trường hợp, tổn thương đa ổ xuất hiện ở 20% các trường hợp và tương tự như di căn não, chúng có phù nề lan rộng trên hơn 3 tâng đốt sống (vertebral segments). Di căn xương đồng thời là phổ biến và cần phải được tìm kiếm.
Chẩn đoán phân biệt chính là một khối u hệ thần kinh trung ương nguyên phát. Rykken [31] đã mô tả hai lần xuất hiện hương tới tổn thương di căn (trừ tổn thương ác tính nguyên phát của hệ thần kinh trung ương). Dấu hiệu viền (ring sign, một viền ngấm thuốc hoàn toàn hoặc không hoàn toàn bên ngoài của trung tâm ngấm thuốc) và dấu hiệu ngọn lửa (flame sign, ngấm thuốc khó được xác định ở cực trên hoặc dưới của tổn thương trông giống như tia lửa) (Hình 16).
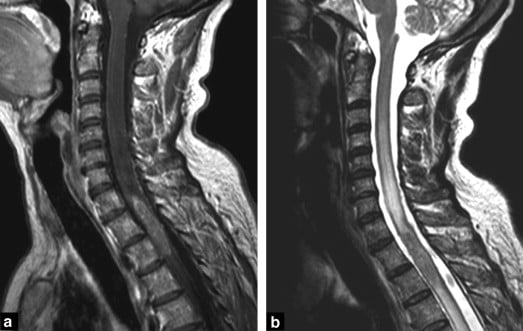
Hình 16. Di căn trong ống sống từ ung thư vú. Lưu ý sự xuất hiện dấu hiệu ngọn lửa của ngấm thuốc tương phản ở cực trên của tổn thương (a) và phù nề đáng kể xung quanh tổn thương trên hình ảnh T2W (b).
2.2. Di căn ngoài màng cứng, dưới màng cứng và màng não (Epidural, subdural and meningeal metastases)
Kiểm tra với thuốc tương phản nên bao gồm các rễ của chùm đuôi ngựa (roots of cauda equina) và phần cuối của túi màng cứng (end of the dural sac) và không nên dừng lại ở nón tủy (conus medullaris) (Hình 17, Hình 18, Hình 19).

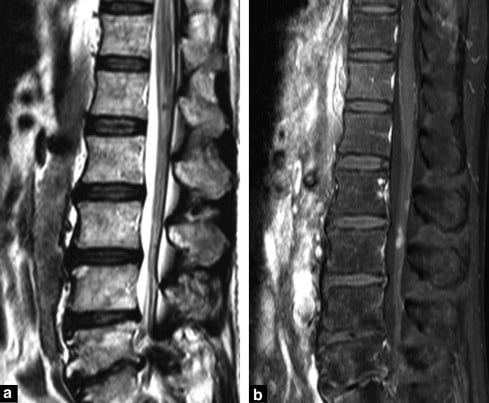
Hình 17. Di căn ngoài màng cứng sau trái (left posterior epidural metastases) từ ung thư biểu mô tuyến phổi. Ngấm thuốc tương phản không đồng nhất trên hình ảnh T1W sagittal (a) và khối đè đẩy tủy sống (spinal cord) về phía trước trên hình ảnh T2W axial (b).
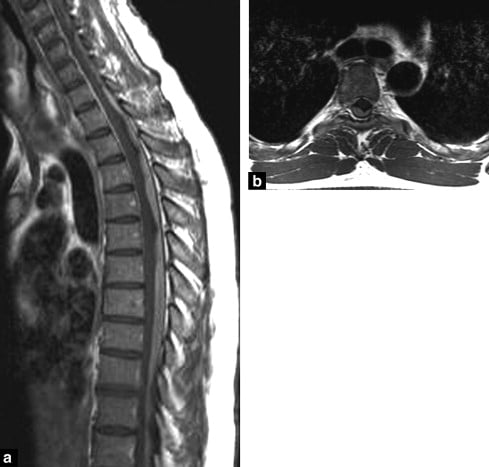
Hình 18. Hình ảnh “lờ mờ” (hazy) được nhìn thấy trên chuỗi xung T2W (a), được tạo ra bởi sự tăng tín hiệu dịch não tủy trên T2, ngấm thuốc trên chuỗi xung T1W xóa mỡ (b) phản ánh di căn màng não từ ung thư vú (meningeal metastases from a breast cancer).
Hình 19. Ngấm thuốc tương phản dưới màng cứng (subdural) (a) và hai thùy (bilobulated) (b) đại diện cho sự xâm lấn của u nguyên bào tủy (medulloblastoma).
Tổn thương màng não xuất hiện dưới dạng nốt ngấm thuốc tương phản dọc theo tủy sống và các rễ chùm đuôi ngựa. Màng cứng có thể liên quan một trong hai trong sự cô lập hoặc có thể làm phức tạp di căn xương và thường xuất hiện như một tổn thương trục hình mà nén tủy sống đến một mức độ nhiều hay ít. Di căn xương đồng thời phải được tìm kiếm thường xuyên.
3. Kết luận (Conclusion)
Di căn não biểu hiện rất đa dạng và phải luôn luôn được cân nhắc ở những bệnh nhân có tiền sử bệnh lý ác tính hoặc có nhiều tổn thương. Những tiến bộ trong các lựa chọn điều trị làm cho việc đánh giá hình ảnh học tối ưu là cần thiết, đôi khi sử dụng các kỹ thuật tiên tiến. Kiến thức về các phương pháp điều trị được sử dụng là cần thiết để giải thích các đặc điểm sau hóa xạ. Các tổn thương cột sống (ngoài việc mở rộng di căn vào xương) thường bị bỏ sót và rất hiếm khi được tìm kiếm hằng ngày, trong khi chúng có thể không có triệu chứng.
Thông điệp cần ghi nhớ (Take-home messages):
- Bất kỳ tổn thương não nên xem xét di căn ở bệnh nhân có tiền sử bệnh ác tính trong quá khứ.
Any cerebral lesion should suggest a metastasis in patients with a past history of malignancy. - Di căn não thường nhiều ổ nhưng có thể đơn độc. MRI là phương pháp nhạy nhất để chẩn đoán.
Cerebral metastases are often multiple but may be single. MR is the most sensitive investigation to diagnose these. - MRI tưới máu, khuếch tán và phổ phân biệt di căn với các tổn thương không ác tính khác (áp xe, u hạt, vv).
Perfusion, diffusion and spectroscopy distinguish metastases from non-malignant structures (abscesses, granulomatosis, etc.). - Vùng quanh khối u phải được phân tích chi tiết để phân biệt các khối u nguyên phát với di căn não.
The peritumor environment must be analyzed in detail to differentiate primary tumors from cerebral metastases. - Hình ảnh khuếch tán giúp phân biệt di căn với nhiều ổ áp xe.
Diffusion-weighted imaging distinguishes metastases from multiple pyogenic abscesses. - Dấu hiệu ngọn lửa và dấu hiệu viền giúp phân biệt di căn nội sọ với một khối u ác tính nguyên phát.
The flame sign and the ring sign help to distinguish intraspinal metastases from a primary malignancy.
4. Case lâm sàng (Clinical case)
Một bệnh nhân nữ 77 tuổi nhập viện vì một cơn động kinh đầu tiên. Khám lâm sàng cho thấy một khối ở vú phải (Hình 20).

Hình 20. Hình ảnh FLAIR (a), bản đồ ADC (b), hình ảnh T1W tiêm thuốc mặt phẳng axial (c và d) và bản đồ CBV (e).
U nguyên bào đệm đa hình (Multifocal glioblastoma).
Có vài tổn thương vùng đỉnh tạo thành đám (grouped in clusters), không đồng nhất với trung tâm hoại tử và tăng hệ số khuếch tán (heterogeneous with a necrotic centre and increased diffusion coefficient), loại trừ áp xe não. Các tổn thương tăng sinh mạch. Đặc biệt, có bất thường tưới máu vượt ra ngoài vùng ngấm thuốc tương phản trên T1, đặc biệt ở phía trước.
Những biểu hiện này chủ yếu gợi ý một u thần kinh đệm ác tính hơn là tổn thương thứ phát, mặc dù có khối ở vú.
[1] K.E. Smedby, L. Brandt, M.L. Backlund, P. BlomqvistBrain metastases admissions in Sweden between 1987 and 2006; Br J Cancer, 101 (2009), pp. 1919-1924.
[2] J.S. Barnholtz-Sloan, A.E. Sloan, F.G. Davis, F.D. Vigneau, P. Lai, R.E. SawayaIncidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit cancer surveillance system; J Clin Oncol, 22 (2004), pp. 2865-2872.
[3] B. Hakyemez, C. Erdogan, N. Bolca, N. Yildirim, G. Gokalp, M. ParlakEvaluation of different cerebral mass lesions by perfusion-weighted MR imaging; J Magn Reson Imaging, 24 (2006), pp. 817-824.
[4] S. Kremer, S. Grand, F. Berger, D. Hoffmann, B. Pasquier, C. Remy, et al.Dynamic contrast-enhanced MRI: differentiating melanoma and renal carcinoma metastases from high-grade astrocytomas and other metastases; Neuroradiology, 45 (2003), pp. 44-49.
[5] W.T. Yuh, E.T. Tali, H.D. Nguyen, T.M. Simonson, N.A. Mayr, D.J. FisherThe effect of contrast dose, imaging time, and lesion size in the MR detection of intracerebral metastasis; AJNR Am J Neuroradiol, 16 (1995), pp. 373-380.
[6] E.S. Kim, J.H. Chang, H.S. Choi, J. Kim, S.K. LeeDiagnostic yield of double dose gadobutrol in the detection of brain metastasis: intraindividual comparison with double dose gadopentetate dimeglumine; AJNR Am J Neuroradiol, 31 (2010), pp. 1055-1058.
[7] Y. Kato, S. Higano, H. Tamura, S. Mugikura, A. Umetsu, T. Murata, et al.Usefulness of contrast-enhanced T1-weighted sampling perfection with application-optimized contrasts by using different flip angle evolutions in detection of small brain metastasis at 3 T MR imaging: comparison with magnetization-prepared rapid acquisition of gradient echo-imaging; AJNR Am J Neuroradiol, 30 (2009), pp. 923-929.
[8] J. Park, J. Kim, E. Yoo, H. Lee, J.H. Chang, E.Y. KimDetection of small metastatic brain tumors: comparison of 3D contrast-enhanced whole-brain black-blood imaging and MP-RAGE imaging; Invest Radiol, 47 (2012), pp. 136-141.
[9] S.K. Singh, N.E. Leeds, L.E. GinsbergMR imaging of leptomeningeal metastases: comparison of three sequences; AJNR Am J Neuroradiol, 23 (2002), pp. 817-821.
[10] W. Galassi, W. Phuttharak, J.R. Hesselink, J.F. Healy, R.B. Dietrich, S.G. ImbesiIntracranial meningeal disease: comparison of contrast-enhanced MR imaging with fluid-attenuated inversion recovery and fat-suppressed T1-weighted sequences; AJNR Am J Neuroradiol, 26 (2005), pp. 553-559.
[11] H. Fukuoka, T. Hirai, T. Okuda, Y. Shigematsu, A. Sasao, E. Kimura, et al.Comparison of the added value of contrast-enhanced 3D fluid-attenuated inversion recovery and magnetization-prepared rapid acquisition of gradient echo sequences in relation to conventional postcontrast T1-weighted images for the evaluation of leptomeningeal diseases at 3 T; AJNR Am J Neuroradiol, 31 (2010), pp. 868-873.
[12] Y.M. Tang, S. Ngai, S. StuckeyThe solitary enhancing cerebral lesion: can FLAIR aid the differentiation between glioma and metastasis?; AJNR Am J Neuroradiol, 27 (2006), pp. 609-611.
[13] M. Law, S. Cha, E.A. Knopp, G. Johnson, J. Arnett, A.W. LittHigh-grade gliomas and solitary metastases: differentiation by using perfusion and proton spectroscopic MR imaging; Radiology, 222 (2002), pp. 715-721.
[14] J.P. Wijnen, A.J. Idema, M. Stawicki, M.W. Lagemaat, P. Wesseling, A.J. Wright, et al.Quantitative short echo time 1H MRSI of the peripheral edematous region of human brain tumors in the differentiation between glioblastoma, metastasis, and meningioma; J Magn Reson Imaging, 36 (2012), pp. 1072-1082.
[15] K.S. Opstad, M.M. Murphy, P.R. Wilkins, B.A. Bell, J.R. Griffiths, F.A. HoweDifferentiation of metastases from high-grade gliomas using short echo time 1H spectroscopy; J Magn Reson Imaging, 20 (2004), pp. 187-192.
[16] S. Cha, J.M. Lupo, M.H. Chen, K.R. Lamborn, M.W. McDermott, M.S. Berger, et al.Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging; AJNR Am J Neuroradiol, 28 (2007), pp. 1078-1084.
[17] P. Lehmann, G. Saliou, G. de Marco, P. Monet, S.E. Souraya, A. Bruniau, et al.Cerebral peritumoral edema study: does a single dynamic MR sequence assessing perfusion and permeability can help to differentiate glioblastoma from metastasis?; Eur J Radiol, 81 (2012), pp. 522-527.
[18] N. Mouthuy, G. Cosnard, J. Abarca-Quinones, N. MichouxMultiparametric magnetic resonance imaging to differentiate high-grade gliomas and brain metastases; J Neuroradiol, 39 (2012), pp. 301-307.
[19] T. Ebisu, C. Tanaka, M. Umeda, M. Kitamura, S. Naruse, T. Higuchi, et al.Discrimination of brain abscess from necrotic or cystic tumors by diffusion-weighted echo planar imaging; Magn Reson Imaging, 14 (1996), pp. 1113-1116.
[20] S. Grand, G. Passaro, A. Ziegler, F. Esteve, C. Boujet, D. Hoffmann, et al.Necrotic tumor versus brain abscess: importance of amino acids detected at 1H MR spectroscopy – initial results; Radiology, 213 (1999), pp. 785-793.
[21] C.H. Toh, K.C. Wei, S.H. Ng, Y.L. Wan, C.P. Lin, M. CastilloDifferentiation of brain abscesses from necrotic glioblastomas and cystic metastatic brain tumors with diffusion tensor imaging; AJNR Am J Neuroradiol, 32 (2011), pp. 1646-1651.
[22] T.M. Holmes, J.R. Petrella, J.M. ProvenzaleDistinction between cerebral abscesses and high-grade neoplasms by dynamic susceptibility contrast perfusion MRI; AJR Am J Roentgenol, 183 (2004), pp. 1247-1252.
[23] C.H. Toh, K.C. Wei, C.N. Chang, P.W. Hsu, H.F. Wong, S.H. Ng, et al.Differentiation of pyogenic brain abscesses from necrotic glioblastomas with use of susceptibility-weighted imaging; AJNR Am J Neuroradiol, 33 (2012), pp. 1534-1538.
[24] F. Cotton, P. Ongolo-Zogo, G. Louis-Tisserand, N. Streichenberger, M. Hermier, A.Jouvet, et al.Diffusion and perfusion MR imaging in cerebral lymphomas; J Neuroradiol, 33 (2006), pp. 220-228.
[25] N. Mauz, A. Krainik, I. Tropres, L. Lamalle, E. Sellier, O. Eker, et al.Perfusion magnetic resonance imaging: comparison of semiologic characteristics in first-pass perfusion of brain tumors at 1.5 and 3 Tesla; J Neuroradiol, 39 (2012), pp. 308-316.
[26] I. Harting, M. Hartmann, G. Jost, C. Sommer, R. Ahmadi, S. Heiland, et al.Differentiating primary central nervous system lymphoma from glioma in humans using localized proton magnetic resonance spectroscopy; Neurosci Lett, 342 (2003), pp. 163-166.
[27] Y.Z. Tang, T.C. Booth, P. Bhogal, A. Malhotra, T. WilhelmImaging of primary central nervous system lymphoma; Clin Radiol, 66 (2011), pp. 768-777.
[28] P.E. Huber, H. Hawighorst, M. Fuss, G. van Kaick, M.F. Wannenmacher, J. DebusTransient enlargement of contrast uptake on MRI after linear accelerator (linac) stereotactic radiosurgery for brain metastases; Int J Radiat Oncol Biol Phys, 49 (2001), pp. 1339-1349.
[29] T.R. Patel, B.J. McHugh, W.L. Bi, F.J. Minja, J.P. Knisely, V.L. ChiangA comprehensive review of MR imaging changes following radiosurgery to 500 brain metastases; AJNR Am J Neuroradiol, 32 (2011), pp. 1885-1892.
[30] H. Kano, D. Kondziolka, J. Lobato-Polo, O. Zorro, J.C. Flickinger, L.D. LunsfordT1/T2 matching to differentiate tumor growth from radiation effects after stereotactic radiosurgery; Neurosurgery, 66 (2010), pp. 486-491.
[31] J.B. Rykken, F.E. Diehn, C.H. Hunt, L.J. Eckel, K.M. Schwartz, T.J. Kaufmann, et al.Rim and flame signs: postgadolinium MRI findings specific for non-CNS intramedullary spinal cord metastases; AJNR Am J Neuroradiol, 34 (2013), pp. 908-915.
[32] J.B. Rykken, F.E. Diehn, C.H. Hunt, K.M. Schwartz, L.J. Eckel, C.P. Wood, et al.Intramedullary spinal cord metastases: MRI and relevant clinical features from a 13-year institutional case series; AJNR Am J Neuroradiol (2013).
Dịch từ: Grand, S., et al. (2014). “The different faces of central nervous system metastases”, Diagnostic and interventional imaging, 95 (10), 917-931.